Une énorme nouvelle pour ceux d’entre nous dont la vie dépend de l’insuline : après des années de R&D et d’anticipation de la communauté, nous avons maintenant une nouvelle forme de glucagon, la substance d’urgence pour augmenter la glycémie, qui peut simplement être vaporisée dans le nez plutôt que de nécessiter un mélange compliqué trousse et une grosse aiguille effrayante avec laquelle les passants doivent vous poignarder.
Remarquablement, c’est le premier nouveau type de glucagon que nous ayons vu depuis l’introduction des kits d’urgence injectables standard en 1961 !
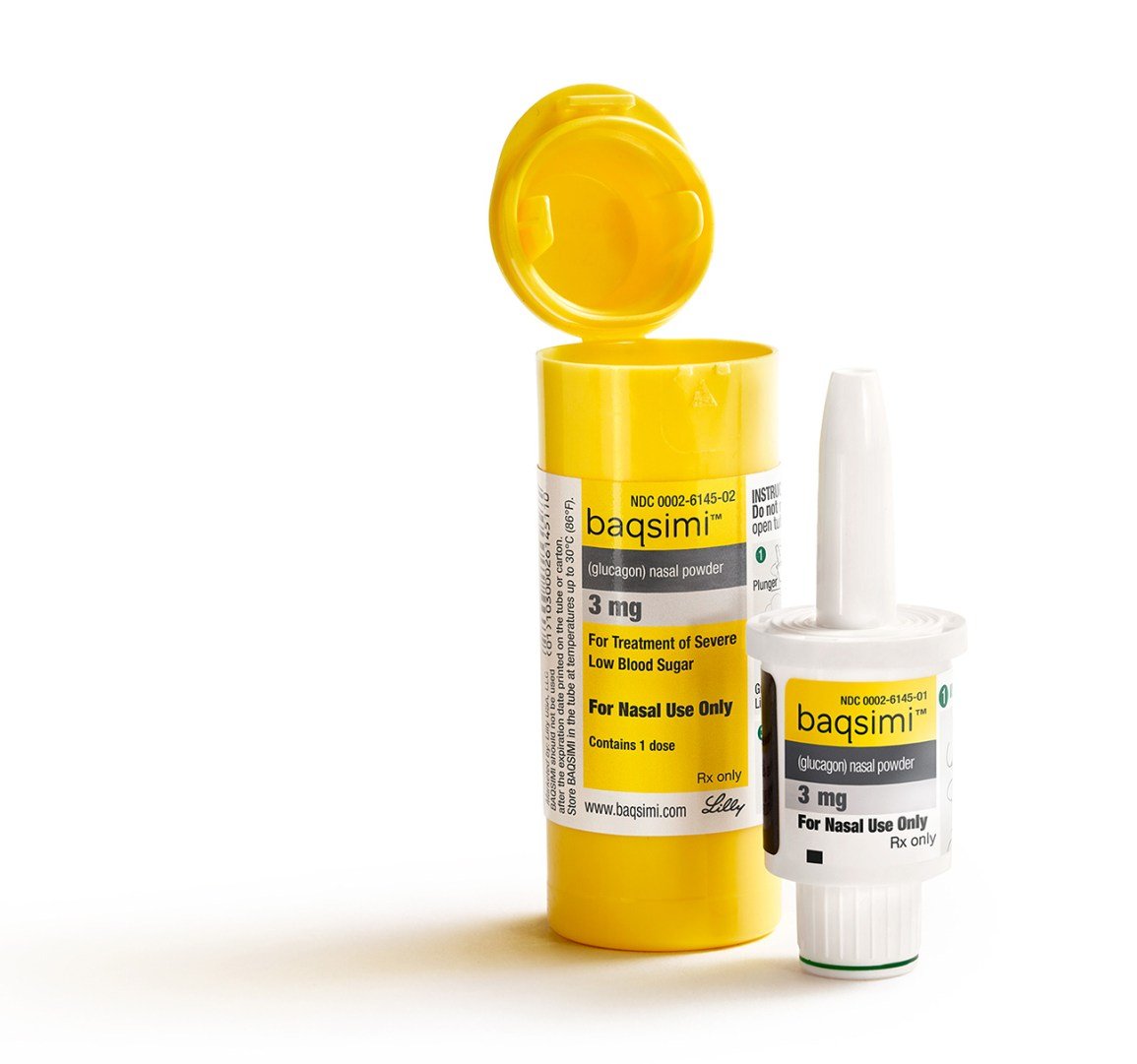
Le 24 juillet, son approbation du nouveau glucagon intranasal connu sous le nom plus sur le nom dans un instant, fabriqué par le géant pharmaceutique Eli Lilly. Cette société est bien sûr un important fabricant d’insuline, mais fabrique également l’un des deux kits de glucagon injectable en plusieurs étapes actuellement disponibles l’autre étant Novo Nordisk. Développé à l’origine par une société biomédicale canadienne, le nouveau glucagon nasal a été acquis par Lilly en 2015 et est en phase avancée d’essais cliniques depuis sa soumission aux régulateurs il y a un an en juin 2018.
Bien qu’il puisse sembler un peu dramatique de décrire ce nouveau médicament comme « historique » et « changeant la donne », c’est certainement une étape importante pour notre communauté car c’est le premier nouveau type de glucagon à arriver sur le marché depuis que les formes injectables originales ont été introduites presque il y a six décennies. En fait, le nouveau produit de Lilly sera disponible à partir d’août 2019, c’est la première des trois nouvelles formes de glucagon qui devraient arriver sur le marché dans un proche avenir, ouvrant la voie à de nouvelles façons d’utiliser le glucagon.
Le PDG de FRDJ, le Dr Aaron Kowalski, qui vit lui-même avec le DT1, a fait la déclaration suivante : « Il s’agit d’une étape importante vers la fourniture de davantage de traitements pour traiter les complications du diabète de type 1. Jusqu’à présent, les injections complexes de glucagon qui nécessitent plusieurs étapes d’administration étaient le seul traitement disponible pour les personnes souffrant d’un épisode hypoglycémique sévère. L’administration de glucagon nasal est un processus beaucoup moins invasif et simplifié qui peut sauver des moments critiques lors d’une urgence, en particulier si une personne perd connaissance. FRDJ est reconnaissante à la FDA pour sa décision et continue de plaider pour que davantage de traitements soient mis sur le marché afin que les personnes atteintes de DT1 puissent mieux gérer ses complications et vivre une vie plus heureuse et en meilleure santé.
Spray nasal Baqsimi : les bases et comment ça marche
Pour rappel, le glucagon est une hormone qui incite le foie à libérer très rapidement du glucose afin d’augmenter la glycémie. Les kits d’urgence de glucagon en plusieurs étapes rouges et oranges familiers ont été la seule option à ce jour et Lilly dit qu’elle continuera à les offrir.
Voici un aperçu de ce produit, y compris le coût et ce qui attend le marché du glucagon :
- Distributeur prêt à l’emploi : Il s’agit d’une dose de 3 mg de glucagon à usage unique, contenue dans un distributeur en plastique compact, portable et prêt à l’emploi. La dose complète est utilisée lors de l’action, donc cela ne permet pas un mini-dosage ce qui n’est pas encore autorisé par la FDA, mais fait par de nombreux patients hors AMM en utilisant le glucagon injectable traditionnel. Fait intéressant, le distributeur est en fait développé par la société AptarGroup basée dans l’Illinois, qui fabrique cela au-delà du glucagon et du diabète.
- Dosage : L’embout du distributeur est inséré dans une narine et vous appuyez/pressez un petit piston au bas de l’appareil pour libérer la dose de poudre sèche de glucagon dans le nez. Ce glucagon est ensuite absorbé dans la muqueuse de la cavité nasale, où il commence à agir immédiatement. Aucune inhalation, reniflement ou respiration profonde n’est nécessaire, ce qui est particulièrement important si la personne handicapée personne diabétique est inconsciente ou n’est pas pleinement consciente de ce qui se passe. Voir .
- Mini-dosage :Pas avec Baqsimi, dit Lilly. Il s’agit d’un distributeur à usage unique, dans lequel vous utilisez la dose complète de 3 mg en une seule fois. Vous poussez le piston jusqu’à ce que la ligne verte disparaisse, indiquant que 100 % de la dose a été administrée. La société dit qu’elle n’a pas exploré le mini-dosage de glucagon à ce jour, car elle s’est concentrée sur ce glucagon de secours d’urgence plus facile à utiliser.
- En cas de rhume ou de congestion : Oui, cela fonctionne même si vous avez un rhume et/ou une congestion nasale et que vous prenez des médicaments pour ces symptômes particuliers. Les données des essais cliniques montrent que ce glucagon est tout aussi efficace dans ces situations.
- Donnée clinique: En parlant d’essais, chez 83 et 70 adultes diabétiques comparant une dose unique de Baqsimi à une dose unique de glucagon injectable, Baqsimi était significativement plus efficace. Il a commencé à fonctionner en quelques minutes et a complètement augmenté la glycémie en 15 à 30 minutes. Dans une étude pédiatrique portant sur 48 patients âgés de plus de 4 ans, des résultats similaires ont été observés.
- Enfants et adultes :Baqsimi est approuvé pour les adultes et les enfants, à partir de 4 ans. Des études d’innocuité et d’efficacité seront également en cours pour les enfants de moins de 4 ans. Lilly dit que la même dose de 3 mg est sans danger pour tous ces âges, qu’il s’agisse d’un homme adulte ou d’un petit enfant.
- Effets secondaires: Il n’y a pas d’avertissements notables dans la boîte noire, mais les effets secondaires possibles reflètent bon nombre de ceux actuellement inclus dans les produits à base de glucagon injectable – yeux larmoyants, rougeurs et démangeaisons des yeux, nausées, vomissements, maux de tête, etc. Il existe également quelques conditions et autres médicaments. qui peuvent influencer l’efficacité de Baqsimi, y compris l’insulinome ou le phéocromocytome, et les bêta-bloquants ou les médicaments à base d’indométacine. Les ingrédients interférents comprennent le bêtadex et la dodécylphosphocholine. De plus, depuis en raison du besoin du foie de gérer l’alcool par rapport au dumping du glucose, cela reste un élément à garder à l’esprit lors de l’utilisation de Baqsimi.
- Stockage: La durée de conservation est de 18 mois à 2 ans, et Lilly dit qu’elle travaille à prolonger cette date d’expiration. Baqsimiv ne nécessite pas de réfrigération et doit être stocké jusqu’à 86 degrés. Il est emballé dans un tube avec film rétractable, et vous êtes censé le conserver dans ce tube avant utilisation. Lilly dit que l’exposition à l’humidité pourrait nuire à l’efficacité du glucagon nasal.
- Disponibilité: Baqsimi sera en vente dans les pharmacies à partir d’août 2019. Une ordonnance sera requise, ce qui signifie qu’il ne sera pas disponible en vente libre OTC. Vous trouverez ci-dessous plus de détails sur l’accès et les prix.
Pour ceux qui s’intéressent à plus de détails de la FDA sur Baqsimi, l’agence a publié son ainsi que le pour examen.
Injecter du glucagon dans le nez
Rappelez-vous, Basqimi est le même glucagon nasal que j’ai utilisé, avant que Lilly n’achète le produit. Mon expérience a été la suivante :
Après avoir été mis sous perfusion d’insuline pour faire chuter mon taux de glucose dans les années 50 et 40, on m’a demandé d’administrer le glucagon expérimental dans mon nez. J’avais l’impression qu’il commençait à fonctionner en quelques minutes – certainement beaucoup plus rapidement que le glucagon injectable normal que j’avais été obligé d’utiliser un mois plus tôt. En 15 minutes, toutes mes sensations basses étaient passées et mes lectures de CGM et de doigt de la clinique ont montré que mes sucres étaient en hausse. En quelques heures, mes niveaux de glycémie sont revenus aux faibles 200, là où ils planaient avant l’expérience.
Bien sûr, beaucoup d’autres ont participé à ce procès et d’autres au fil des ans. Nous avons également été fascinés de voir éventuellement des études « réelles » montrant la facilité d’utilisation pour les personnes handicapées et les soignants qui pourraient avoir besoin de recourir à ce glucagon en cas d’urgence. Tout cela a prouvé que ce glucagon nasal est beaucoup plus facile à utiliser et tout aussi efficace que ce que nous avions disponible toutes ces années.
Glucagon Baqsimi nasal : qu’y a-t-il dans un nom ?
Il se prononce «BACK-see-mee» et Lilly a acquis le nom avec le produit lui-même lors de l’acquisition en 2015 d’une startup basée au Canada – dont le nom de l’entreprise est un mélange d’«hypoglycémie» et d’«hypoglycémie». On nous dit que l’inspiration originale du nom Basqimi est venue de conversations au sein de la communauté du diabète sur « qui vous soutient » lorsqu’il s’agit d’aider les gens lors d’urgences effrayantes pour l’hypoglycémie.
Locemia était dirigée par , un entrepreneur avec une longue histoire dans l’industrie du diabète et un papa lui-même avec deux fils qui ont développé le DT1 à un mois d’intervalle en 1997. Son curriculum vitae comprend un certain nombre de produits de soins du diabète, y compris le travail dans la création du populaire Dex4 comprimés de glucose qui sont maintenant abandonnés aux États-Unis, au moins. Lui et les chercheurs ont commencé à travailler sur cette formulation de glucagon intranasal en 2010.
Le groupe espérait sensibiliser le public à l’hypoglycémie et changer la façon dont le glucagon est perçu, afin qu’il soit plus visible avec des traitements facilement disponibles, comme les défibrillateurs et l’EpiPen dans les restaurants, stades, écoles et autres lieux publics.
« Je suis très reconnaissant à tous ceux qui ont contribué pendant tant d’années au développement de ce produit incroyable et d’une importance vitale, y compris notre petite mais puissante équipe de Locemia, les chercheurs qui ont mené nos essais cliniques, les utilisateurs d’insuline qui se sont portés volontaires pour faire partie de nos essais, nos conseillers scientifiques, nos défenseurs des patients, nos investisseurs et d’innombrables autres », a-t-il écrit dans un e-mail.
« Claude Piche, co-fondateur et PDG de Locemia, et moi-même sommes tous deux très reconnaissants envers l’équipe d’Eli Lilly qui a reconnu la valeur de Baqsimi il y a plus de cinq ans et a montré son engagement en prenant les mesures nécessaires pour l’acquérir, continuer à investir dans celle-ci , et le mettre sur le marché. Vous ne pouvez pas commencer à imaginer le nombre de membres talentueux de l’équipe Lilly qui ont contribué à ce moment et continuent de travailler pour amener Baqsimi au monde. Oui, les États-Unis seront les premiers, mais j’espère que le Canada où le développement a eu lieu, l’Europe et d’autres pays auront Baqsimi disponible pour les utilisateurs d’insuline et ceux qui les aiment ou s’en soucient.
Accès et abordabilité du Baqsimi Glucagon
Lilly dit qu’elle s’attend à ce que Baqsimi soit disponible dans les pharmacies américaines à partir de la fin août 2019, et ils l’ont déjà soumis aux agences de réglementation au Canada, en Europe et au Japon où il est toujours en cours d’examen.
On nous dit que Baqsimi aura le même prix catalogue que le kit d’urgence de glucagon injectable de Lilly : 280,80 $ pour un seul distributeur, et un pack de deux coûtera 561,60 $.
C’est décevant.
Beaucoup dans la Communauté D espéraient que cette nouvelle forme de glucagon serait plus abordable, plutôt que d’être aussi inabordable qu’une fiole d’insuline aux États-Unis ces jours-ci. Alors que le prix de l’insuline et l’accès aux dispositifs pour le diabète ont fait l’actualité ces derniers temps, le prix du glucagon est resté moins discuté dans notre communauté D et au-delà.
Interrogé sur les inquiétudes concernant le prix catalogue élevé, un porte-parole de Lilly nous a dit que la société propose une carte d’épargne Baqsimi jusqu’à la fin de 2020 pour ceux qui ont une assurance commerciale pour obtenir 2 packs Baqsimi ou 1 pack de deux, pour aussi peu que 25 $. Ce sera bon pendant 12 mois, ce qui signifie que la carte sera valable pendant un an et peut être utilisée autant de fois que vous obtenez une nouvelle ordonnance Baqsimi. Ils ont également une offre de premier remplissage où certains peuvent obtenir un seul produit Baqsimi ou un pack de 2 sans frais, avant que le programme d’économies ne démarre pour les recharges. Ce programme « » sera destiné aux personnes « éligibles », ce qui signifie qu’il y aura des critères spécifiques. Ils ont également fait référence à d’autres cartes d’épargne, aux programmes d’assistance aux patients PAP et à leurs créations pour offrir une aide financière à ceux qui sont éligibles pour les médicaments contre le diabète, y compris l’insuline et le glucagon.
« Nous comprenons l’impact financier de la gestion du diabète sur les familles. Lilly s’engage à rendre Baqsimi abordable et accessible au plus grand nombre de personnes atteintes de diabète en garantissant l’accès auprès des payeurs ainsi qu’à travers nos offres d’abordabilité », a déclaré Tony Ezell, vice-président de Lilly pour les soins connectés et les insulines aux États-Unis.
Lorsqu’on nous a demandé ce que la communauté des patients pouvait attendre de Lilly sur le prix du glucagon, nous, à la ‘Exploiter leur a clairement dit que ce prix sera probablement considéré par la communauté comme sourd, et cela signifiera que le glucagon nasal restera interdit à un grand nombre de patients.
Bien entendu, certains régimes d’assurance peuvent très bien couvrir ce nouveau glucagon Baqsimi. Et l’option des deux packs peut permettre aux gens d’obtenir le double du montant pour une seule quote-part. C’est tout à déterminer, car Lilly travaille avec les compagnies d’assurance et les Pharmacy Benefit Managers PBM pour que ce nouveau glucagon soit inclus dans les formulaires.
Il est également important de savoir que deux autres nouvelles formulations de glucagon sont en préparation et une est actuellement devant la FDA :
- Produits pharmaceutiques Xeris : Cette société de Chicago a développé un stylo de sauvetage hypo à usage unique appelé . Il s’agit d’un produit de première génération sous une forme très similaire à l’EpiPen, et la FDA devrait prendre une décision à ce sujet d’ici la fin de l’année 2019. Xeris travaille également sur une version de nouvelle génération qui permettra un mini-dosage au-delà de l’hypo réponse.
- Zélande Pharma : Cette société basée au Danemark développe une nouvelle version appelée, une formule de glucagon soluble qui peut être utilisée dans les pompes à insuline. Il est en cours de test dans le système en boucle fermée iLET Bionic Pancreas en cours de développement. Dasiglucagon est également en cours de développement à l’instar du facteur de forme Xeris. La Zélande dit maintenant qu’elle prévoit de déposer sa formulation de glucagon stable auprès de la FDA au début de 2020.
Appel à l’aide sur Glucagon Access
Autour de notre D-Community en ligne, les réponses sont mitigées sur Baqsimi.
La plupart conviennent qu’il s’agit certainement d’une grande nouvelle et digne d’être célébrée, étant donné le nouveau formulaire de livraison facile. Nous avons vu que cela pourrait révolutionner la façon dont le glucagon est perçu et compris par le grand public.
Mais la question de l’abordabilité et de l’accès ou de son absence est une sorte de nuage sombre, avec des sentiments comme ce Tweet de type 1 de longue date : « J’espère que Xeris et/ou Zealand mange le déjeuner de Lilly avec leurs formations liquides stables. Le potentiel du micro-dosage liquide par rapport à l’intranasal seul ouvre BEAUCOUP plus d’applications. »
Sur le front du plaidoyer, il y a un – pour les écoles, les infirmières et même les ambulanciers paramédicaux. Peut-être que maintenant, avec une version non injectable incroyablement facile à utiliser, certains changements de politique peuvent survenir pour amener les distributeurs de secours de glucagon dans davantage de lieux publics et à ceux qui en ont le plus besoin.
Pour notre part, nous sommes ravis de voir un moyen plus simple et plus doux de traiter les urgences d’hypoglycémie, et nous remercions tous les scientifiques et dirigeants qui ont rendu cela possible.
Dans le même temps, nous espérons que Lilly écoutera ces commentaires de la communauté appelant à l’aide sur l’accessibilité et l’accès à cette innovation importante dans le traitement d’urgence au glucagon pour les hypos sévères.









